BÖLÜM 13: İNTRAOKÜLER TÜMÖRLER
DOÇ. DR. ŞENGÜL ÖZDEK
-
- Retinoblastom
- Uveal Tümörler
- Metastatik Tümörler
- RETİNOBLASTOM
Çocukluk çağının en yaygın primer intraoküler tümörü olup, sıklıkta tüm yaşlar içerisinde koroidal melanomlardan sonra ikinci sırada yer almaktadır. Yine de nadir bir tümör olup, 18.000 canlı doğumdan birinde ortaya çıkar. Retinoblastom, primitif retina hücrelerinin farklılaşmasından önce malign transformasyona uğramasıyla ortaya çıkmaktadır. Vakaların çoğunluğu 3 yaşından önce klinik belirti verir. Bu primitif hücreler, hayatın ilk 3 yılından sonra ortadan kaybolacakları için, söz konusu tümör bu yaştan sonra çok nadir olarak görülmektedir.
Retinoblastom bir ya da iki gözü etkileyebilir. Sağ göz, sol göze göre daha sık etkilenir. Bilateral retinoblastom genellikle multifokal gözlenirken, unilateral tümörlerin %15’inde multifokal lezyonlar mevcuttur. İki taraflı vakalar genellikle 1 yaşından önce tanı alırken tek taraflı vakalarda tanı yaşı daha geç olup 2 yaştır.
Genetik Danışmanlık
Retinoblastomların yaklaşık %60’ı sporadiktir, kalanları aileseldir, tümöre duyarlılık otozomal dominant yola benzer bir şekilde iletilir. 1974 yılında Knudson tümörün sporadik ve ailesel geçişini tanımlamak için iki vuruş hipotezini ileri sürmüştür. Bu hipoteze göre retinoblastom oluşabilmesi için iki mutasyon (vuruş) gereklidir. Bunlar 13q14 kromozomunda oturan Rb genini ilgilendirir. Retinoblastom gelişimi için Rb loküsündeki normal allellerin her ikisinin de inaktive olması gereklidir (iki vuruş). Ailesel vakalarda çocuklar germ dizisindeki Rb geninin bir defektif kopyasını direkt olarak aileden alırlar, diğer kopya normaldir. Retinoblastta tek bir somatik mutasyon retinoblastom gelişimi için yeterli olur. Sporadik vakalarda, retinoblastom oluşabilmesi için normal olan iki Rb allellerinin her ikisinin de kaybedilmesi gereklidir yani ard arda iki somatik mutasyona ihtiyaç vardır.
Kalıtsal olmayan sporadik olgular genellikle (%85) tek taraflıdır ve genellikle bilateral olan kalıtsal olgulara göre (ilk 1 yaş) daha geç, genellikle 1-3 yaşlarında tanı alırlar. Bu olgular hastalığı çocuklarına aktarmayacaklardır.
Kalıtsal retinoblastom, vakaların %40’ından sorumludur fakat bu hastaların sadece %6’sında bu hastalığa dair aile hikayesi yeralmaktadır. Tümörü gelecek nesillere aktarma riski %50’dir. Bu vakalarda, pinealoblastom (trilateral retinoblastom) ve osteojenik sarkom başta olmak üzere ikinci bir gözdışı tümör gelişme riski oldukça yüksektir (50 yılda %26) ve bu olguların bu yönden yetişkin dönemde de takipleri önemlidir.
Retinoblastom için genetik danışma çok karmaşık olabilirse de birkaç genel prensip uygulanmaktadır (Tablo 13.1). Bilateral tutulumu olan çocuğa sahip normal ebebeynlerin ikinci bir etkilenmiş çocuk sahibi olma riski %5’dir. Eğer iki ve daha fazla kardeş etkilenmişse her yeni çocuk için risk %45’dir. Hayatta kalmış herediter retinoblastom hastasının çocuğunda etkilenme riski %50’dir. Eğer bir hastada bilateral retinoblastom saptanırsa germinal mutasyon gösterme şansı yaklaşık %98 olarak bulunmuştur.
Tablo 13.1: Retinoblastomda genetik danışmanlık
Anne-babada Bilateral RB (+) Unilateral RB (+) Normal
Çocukta RB riski %45 (+) %55 (-) %7-15(+) %85-93(-) <<%1(+)
¯ ¯ ¯ ¯ ¯ ¯ ¯ ¯
Lateralite %85 %15 %0 %85 %15 %0 %33 %67
bilat unilat ¯ bilat unilat ¯ bilat unilat
¯ ¯ ¯ ¯ ¯ ¯ ¯ ¯ ¯ ¯ ¯
%100 %96 %4 %0 %100 %96 %4 %0 %100 %15 %85
Fokalite multi multi uni ¯ multi multi uni ¯ multi multi uni
fokal fokal fokal ¯ fokal fokal fokal ¯ fokal fokal fokal
¯ ¯ ¯ ¯ ¯ ¯ ¯ ¯ ¯ ¯ ¯
Bir sonraki %45 %45 %45 %45 %45 %45 %45 %7-15 %5 <%1 <%1
Çocukta RB
Riski
Bulgular ve tanı
Lökokori en sık bulgudur (Tablo 13.2). Tümörün kendisinden kaynaklanabileceği gibi, tümör ile birlikte bulunan sekonder retina dekolmanı ya da arka kutupta beyaz tümör kitlesinden ışık yansımasından kaynaklanabilir. Strabismus genellikle ezotropya şeklindedir. Bir infantta şaşılık varlığında diğer nedenler ekarte edilinceye kadar retinoblastomdan şüphelenilmelidir. Gelişmekte olan ülkelerde geç başvuru nedeniyle tanı anında proptozise ve orbital kitle şeklinde ekstraoküler yayılıma sık rastlanır. Hastaların %6-10’unda enflamasyondan kaynaklanan ağrılı glokom görülebilir ve orbital selülite benzer kliniktedir.
Tablo 13.2: Retinoblastomda ilk başvurudaki bulguların dağılımı
Lökokori %60
Şaşılık %20
Üveit (enflamasyon, hipopyon) %8-10
Hifema
Heterokromi
Proptozis (gelişmekte olan ülkelerde sık)
Katarakt
Glokom
Anizokori
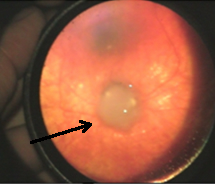
Retinoblastom, kendini erken dönemde düz ya da yuvarlak bir intraretinal tümör şeklinde gösterir. Endofitik olarak büyüyen tümörler, üzerinde ince kan damarları bulunan, sekonder kalsifikasyon varlığında sınırları belirgin kırılgan beyaz bir kitle görünümündedir ve tanıları daha kolaydır (Resim 13.1). Ekzofitik büyüyen tümörler, üzerinde retina dekolmanının yeraldığı multiglobüler yapıda beyaz bir kitle şeklindedir ve tanısı daha zordur.
Retinoblastom tanısını koymada USG; kalsifikasyonların görülmesinde ve tümör boyutlarının ölçülmesinde yardımcıdır (bkz resim 20.21). Orbital CT, kalsifikasyonları gösterebilir, yayılımın değerlendirilmesinde tercih edilebilir (resim 2). MR, kalsifikasyonu tespit etmese de optik sinirin değerlendirilmesi (invazyon açısından) ve pinealoblastoma tesbiti açısından CT’den üstündür.
Ayırıcı tanı
Retinoblastom en sık diğer lökokori nedenleri ile karışabilir (Tablo 3). Coats Hastalığı kalıtsal olmayan özellikle erkek çocukları etkileyen unilateral görülen hastalıktır. Tanı yaşı retinoblastomdan daha geçtir (ort 6 yaş). Oftalmolojik muayenede intraretinal ve subretinal eksudalar ile retinada telanjiektazik damarlar ve eksudatif retina dekolmanı görülebilir. İndirekt oftalmolojik muayenede sarı-yeşil parlaklık varlığı retinoblastomdan ayırıcı özelliktir.
Tablo 13.3: Retinoblastomda ayırıcı tanı
Ayırıcı Tanıda İpuçları
Coats hastalığı Daha geç presentasyon, erkek, tek taraflı
Persistan Fetal Vaskülatür (PFV) Tek taraflı, mikroftalmi, doğuştan mevcudiyet
Toxocara Tek taraflı, geç presentasyon, kedi-köpek teması
Prematürite Retinopatisi (ROP) Prematürite, düşük doğum ağırlığı
Katarakt
Retinoblastom ile karışabilecek diğer bir hastalık eski adıyla persistan hiperplastik primer vitreus olan persistan fetal vaskülatürdür. Konjenital ama kalıtsal olmayan ve genellikle unilateral olan bir anomalidir. Doğumda ya da birkaç yıl sonra fark edilir. Opak şeffaf ve bazen vaskülarize olan membranın lens arkasında lokalize olmasıyla kendini lökokori ile gösterir. Tipik olarak mikroftalmik bir gözde bulunur. Bu gözlerde katarakt, glokom, retina dekolmanı ve fitizis bulbi gelişebilir.
Prematürite Retinopatisi; ileri dönemlerinde retina dekolmanı ve lökoriye neden olarak retinoblastom ile karışabilir. Prematürelik ve düşük doğum ağırlığı hikayesi sayesinde kolaylıkla tanı konabilir.
Oküler Toksokariazis; retinoblastomu taklit edebilir. Endoftalmi veya soliter granülomlar şeklinde presente olabilir. Soliter granülomlar, tek taraflı olmakla birlikte, genellikle retinoblastoma göre çok daha geç (6-14 yaş) presente olur. Diğer taraftan endoftalmi formu daha erken (2 yaş) civarında ortaya çıkarak retinoblastomdan ayırıcı tanı açısından güçlük çıkarabilir.
Prognoz
Optik sinir tutulumu ve koroidal invazyonu olan, büyük çocuklarda prognoz kötü iken, özellikle arka kutupta yerleşmiş küçük tümörlerde ve histolojik olarak Flexner- Wintersteiner rozetleri bulunan iyi diferansiye tümörlerde prognoz daha iyidir.
Retinoblastomun prognoz ve tedavi açısından evrelenmesi için en sık kullanılan sistem, tümör sayısı, lokalizasyonu ve büyüklüğüne göre yapılan Reese Elsworth sistemi’dir ve 5 evrede incelenmektedir. Diğer sınıflandırma sistemleri olan Abramson Grabowski sistemi ve TNM evreleme sistemi ise hastalığın yayılımına göre evreleme yapmaktadır.
Tedavi edilmemiş retinoblastom 5 yolla yayılım gösterir;
- a) Komşuluk ile koroid, skleraya ve orbitaya yayılım,
- b) Optik sinir ile beyine yayılım,
- c) Subaraknoid boşluk ve leptomeninks ile BOS’a yayılım,
- d) Hematojen yolla kemik iliği, kemik, karaciğer ve dalak yayılımı,
- e) Konjonktival lenfatik drenaj ile disseminasyon görülür.
Uzak metastazların en sık görüldüğü yerler santral sinir sistemi, kafa kemikleri, distal kemikler ve lenf nodlarıdır. Mortaliteyi arttıran en önemli risk faktörü ekstraoküler yayılım varlığıdır. Bu yayılım en sık optik sinir yoluyla veya skleraya yayılımla olur.
Tedavi:
Tedavi yaklaşımlarına, intraokuler ya da ekstraoküler hastalığın varlığına göre karar verilir. Retinoblastomda tercih edilen tedavi modaliteleri;
1- Fokal Tedaviler: Fotokoagülasyon, krioterapi, transpupiller termoterapi: Küçük tümörlerde.
2- Enükleasyon: Büyük tümörlerde,
3- Plak Radyoterapi (Brakiterapi),
4- Yüklü Işın Radyoterapi,
5- Sistemik ve Periokuler Kemoterapi: Ekstraoküler veya sistemik yayılım varlığında.
Retinoblastomda çok ender olarak spontan regresyon görülebilir.
Son yıllarda kemoredüksiyon gündeme gelmiştir. Kemoredüksiyonda Vinkristin, Etoposid ve Karboplatin ile yapılan kemoterapi ile tümörün boyutlarının küçülmesi sonrasında fokal tedaviler veya plak radyoterapi ile tümörün tamamen yokedilmesi ve gözün korunması mümkün olabilmektedir.
- UVEAL MELANOMLAR
Yetişkinde primer intraoküler malignensilerin en sık görüleni üveal traktus melanomlarıdır. USA’da ortalama yaşa bağlı indisansı her milyon populasyonda yaklaşık 4.3 yeni vakadır. Üveanın nöroektodermal melanositlerinden köken alırlar. Görüldüğü ortalama yaş 55-62 yaştır. 30 yaş altı nadirdir ve beyaz ırkta 15 kat daha sık görülür.
Üveal melanom gelişiminde çeşitli faktöler rol oynar. Az pigmentasyon (deri, saç, göz rengi) gibi kişisel özellikler, genetik faktörler ve çevresel faktörler (güneş ışığı, kimyasal) riski arttırırlar. Oküler melanositoz ve ota nevüs varlığı nelanom riskini arttıran faktörlerdir. Üveal melanomların klinik belirtisi çeşitlidir. Hastaların yaklaşık %33’ü klinik tanı esnasında asemptomatiktir.
Uveal melanomlar en sık koroidde, en az irisde görülür. Bunlar içinde en iyi prognoza sahip olan iris melanomları iken, silier melanomlar en kötü prognoza sahiptir. Uveal melanomlar histolojik olarak, spindle A hücreli, spindle B hücreli, epiteloid hücreli ve karışık olmak üzere dörde ayrılır. Spindle hücreli tümörler iyi prognoza sahipken epiteloid hücreli olanlar en kötü prognoza sahiptir ve nadir görülürler (%3). Collabarative Ocular Melanoma Study (COMS) sonuçlarında karışık hücreli melanomların en sık rastlanan tümör tipi olduğu bildirilmiştir (%86). Anterior yerleşimli koroidal tümörler, arka kutup yakınlarındaki tümörlere nazaran genellikle daha geç teşhis edildikleri için daha kötü prognoz taşımaktadır. İleri yaş, ekstraoküler yayılım, metastaz varlığı kötü prognoz belirtisi olup yaşam beklentisini kısaltır.
COMS, oküler melanomları tümör çapı ve kalınlıklarını esas alarak büyüklüklerine göre küçük, orta ve büyük tümör olarak sınıflandırmıştır (Tablo13.4).
Tablo 13.4: Oküler melanomların büyüklüklerine göre sınıflandırması
Tümör Kalınlık Çap
Küçük ≤2.5 mm ≤6mm
Orta 2.5mm-l0mm 6mm-16mm
Büyük >10mm >16mm
- İris Melanomları
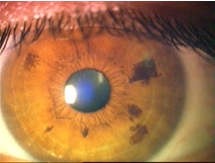
İrisin çoğunlukla inferior yarısında yerleşen, düz veya düzensiz yüzeyli, genellikle 3mm’den geniş ve 1mm kalınlığında pigmentli ya da pigmentsiz nodüller şeklindedir. Tümör üzerindeki damarlar pigmentsiz bir tümörde kolayca tespit edilebilir.
Pupilla distorsiyonu, ektropion üvea, lokalize lens opasiteleri veya sekonder glokom gibi bulgular eşlik ediyorsa malignite lehinedir.
Tümörün fotografik takibi lezyonun büyüme veya progresyonunu değerlendirmek için en önemli tetkiktir. USG lezyonların bazal çapı ve kalınlığını ölçmede, anterior silyer cismi, açı üzerindeki sklera tutulumunu değerlendirmede yararlıdır.
Bir anterior üveal melanomun posterior sınırlarını değerlendirmede en etkin metod transluminasyondur. Karanlık bir ortamda güçlü bir ışık kaynağının transkonjonktival veya transkorneal olarak göze tutulması şeklinde yapılan transluminasyonunda pars plikata ve pars plana bölgesine tümör gölgesi düşer ve tümör sınırları karanlık olarak net bir şekilde görülebilir.
Ayırıcı tanıda sıklıkla karşılaşılan iris nevüsleri ilk sırayı alırlar. genellikle 3mm’den küçük, düz ya da hafif kabarık, pigmentli lezyondur. İrregüler pupil, köşeli yapı, sekonder katarakt, sekonder kist ve komşu transskleral yayılım olması bir nevuste malign davranış belirtileridir. Primer iris kistleri; ya iris pigment epitelinden ya da nadiren stromadan köken alan sabit seyirli, asemptomatik olup tedavi gerektirmezler. Ayırıcı tanıda akılda tutulması gereken diğer lezyonlar, iris pigment adenomu ve metastatik tümörlerdir.
İris melanomlarında tedavi seçenekleri; şüpheli lezyonun fotografik gözlemle takip edilmesi, tümörün lokal eksizyonu, radyoterapi, enükleasyon ve eksenterasyondur.
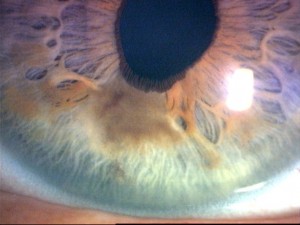
- Silyer Cisim Melanomları
Silyer cisim melanomlarında, tümörün bulunduğu kadranda nöbetçi damarlar olarak adlandırılan episkleral damarların dilatasyonu görülebilir. Tümörün boşaltıcı damarlar yoluyla transskleral yayılımın bir sonucu olarak epibulber pigmente lezyonlar görülebilir. Bazen lens üzerine bası yaparak sekonder astigmatizm, subluksasyon ve lokalize kesafet oluşmasına sebep olabilir. Trabeküler ağ tutulumu olursa sekonder glokom görülebilir. Pupil iyice dilate olduğu zaman silyer kitle görülebilir. Çoğu melanom ağrıya neden olmaz. Bazı ilerlemiş vakalar şiddetli oküler ve perioküler ağrı ile birliktedir. Ağrının temelinde sekonder glokom ya da spontan nekroz vardır.
Silyer cisim melanomları nadir görülür ve oldukça kötü prognoza sahiptir. Bu tümörler sıklıkla geç tanımlanır. Bazı vakalarda tanı koymak güçtür. Silyer cisim melanomu bulunduğu düşünülen gözlerde iyice dilate edilmiş pupilla üzerinden üç aynalı kontakt lens eşliğinde yapılan biomikroskopik muayene uygulanmalıdır. Opak ortamların varlığında tümörün tesbit edilmesinde ve tümörün büyüklüğünü, sınırlarını, lokal invasyonunu değerlendirmek için USG yeterli bilgi sağlayabilir. İnce iğne aspirasyon biyopsisi, seçilmiş vakalarda uygulanabilir. Tümörle kist ayrımında nadiren gerekse de transluminasyon az bir teşhis koyucu değere sahiptir.
Silyer cisim melanomun ayırıcı tanısında, rutin muayene sırasında farkedilen episkleral damarların eşlik etmediği, küçük lezyonların varlığında silyer cisim nevüsleri düşünülmelidir. Silyer cismin pigment epitelinden köken alan, yavaş büyüyen ve lokal invazyon yapan medulloepitelyoma ayırıcı tanıda akla gelmelidir. Ayrıca USG’da kistik yapıya sahip olan üveal efüzyon sendromu, epitelyal iridosilyer kistler ve silyer cismin metastaz, adenokarsinom, kistik adenom, leiomyoma ve hemanjiom gibi diğer tümörlerin melanomdan ayırımı yapılmalıdır.
Silyer cisim melanomlarının tedavisinde, seçilmiş vakalarda plak veya yüklü partiküllerle yapılan radyoterapi, tümörün lokal eksizyonu, enükleasyon ve eksenterasyon yeralmaktadır.
- Koroidal Melanom
Tipik koroidal melanom zeminden kabarık, subretinal oval kitle şeklindedir. Retina pigment epitelinin portakal renkli pigmentinin (lipofuksin) tümörün sathında görülmesi yaygın olsa da teşhis koydurucu bir değer taşımamaktadır. Çoğu koroid-silier cisim melanomu görme kaybı, sinek uçuşması, ışık çakması, skotom gibi visual semptomlara neden olabilir.
Koroidal melanomun %20’si Bruch membranını geçer. Altındaki retinada nodüler erüpsiyon yapar. Bu nodüler erüpsiyonun genişlemesiyle tipik mantar görümünü kazanır. Sekonder eksudatif retina dekolmanı ve yerdeğiştiren subretinal sıvı sıkça görülür. Bazı vakalarda subretinal sıvı lezyon çevresinde yayılırken, bazılarında total retina dekolmanı ile sonuçlanır. Venöz kan akımını engelleyebilir, dilate damarlar rüptüre olarak vitreus hemorajisine neden olabilir.
Koroidal melanomun tanımlanmasında, binoküler indirekt oftalmoskopi ile yapılan muayene, ortamları berrak olan gözlerde çoğunlukla doğru teşhis koymakta yeterli olur. Ayrıca eksudatif retina dekolmanı mevcutken yerdeğiştiren subretinal sıvının tesbit edilmesini sağlar. +78D’lik bir lens ile yapılan biomikroskopi ile lipofuksin pigment varlığı, subretinal sıvı, lezyon üzerini örten sensöryel retinadaki kistoid değişiklikler ve tümör içindeki dilate damarlar gibi özellikleri değerlendirilebilir.
Teşhisin netleştirilmesi ve tümör boyutlarının belirlenmesinde kullanılan ve tercih edilen en kesin metod, USG’dir. Yapılan B mod USG, tümörün relatif büyüklüğü (yüksekliği ve bazal çapı), genel görünümü, introküler tümörün pozisyonu hakkında bilgi verir. B mod USG, mantar gibi koroidal kitlelerde yüksek yansımalı anterior sınır, akustik boşluk, koroidal ekskavasyon ve sıklıkla orbital gölgelenmeyi gösterir. A mod USG ile koroidal tümör, solid tümör paterninde yüksek amplitudülü ilk ekolar ve orta-düşük amplitudlü iç yansıtıcılık gösterir. İntralezyonel vaskülarizasyonu olan tümörlerde nabız ile uyumlu intralezyonel yüksek ekolarda fluktasyon (spontan vasküler pulsasyon) görülür.
Bir patognomonik patern bulunmadığından teşhiste sınırlı bir değere sahip olan floresein anjiografi, tümörü besleyen vasküler yapı hakkında bilgi verir. Koroidal melanomların floresein anjiografisinde kitlede geç lekelenme tarzında boyanma ile arter ve arteriovenöz fazda derin intralezyonel damarların floresansı görünür. RPE düzeyinde erken punktat floresans, geç hiperfloresans ile uyumlu yıldızlı gökyüzü görünümü mevcuttur. Floresein angiografi ile, nevüsten, metastatik tümörden ya da koroidal hemanjiomdan ayırt edilemez. .İndosiyanin yeşil angiografisi; retina pigment epitel değişikliklerinin daha az işe karışımı, tümör ve koroidde yeralan damarların daha iyi görüntülenmeleri ve tümör kenarlarının daha iyi biçimde tanımlanması sayesinde floresein angiografisinden üstündür. CT, ekstraoküler yayılımın tespit edilmesinde faydalı olsa da ne tümör büyüklüğünün hesaplanmasında ne de ayırıcı tanıda USG karşısında bir üstünlüğe sahip değildir. Vitreusun siyah göründüğü T1 ağırlıklı MRI’da parlak (hiperintense), vitreusun beyaz göründüğü T2 ağırlıklı MRI’da koyu (hipointense) görülür ama bu özellikler teşhis koydurucu değer taşımazlar. CT ve MRI, ekstraskleral yayılımı ve diğer organ tutulumunu değerlendirmede tercih edilir. Özellikle ortamları bulanık olan gözlerde pigmentli lezyonların, intraoküler hemorajilerden ayrılmasında renkli doppler görüntülemesi yardımcı olabilir.
Daha az invaziv metodlarla teşhis konulamadığında şüpheli posterior üveal melanomlarda ince iğne aspirasyon biyopsisi tercih edilebilir. Biyopsi sırasında komplikasyon olarak; subretinal hemoraji, vitreus hemorajisi ve küçük silyer tümörlerin biyopsisinde lense zarar verilmesi görülebilir. Biyopsiyi takiben skleral yol boyunca patolojik olarak birkaç melanom hücre implantasyonu bildirilmiştir. Transvitreal, transretinal biyopsi için oluşan biyopsi holünden şimdiye kadar retina dekolmanı bildirilmemiştir.
Koroidal melanomun ayırıcı tanısında nüfusun yaklaşık %1-2’sinde bulunan koroidal nevüs düşünülmelidir. Genellikle asemptomatik, düz veya zeminden minimal yükselme gösteren drusen ile kaplı, kurşuni gri renkli lezyonlardır. Bu ayrımda faydalı olabilecek kolay bir kısaltma Dr. Shields tarafından şu şekilde yapılmıştır. TFSOM= To Find Small Ocular Melanoma (Thickness, Fluid, Symptoms, Orange pigment, Margin). Kalınlığı fazla olan nevüslerde, lezyonla birlikte seröz retina dekolmanı olması, semptomatik olması (ışık çakmaları gibi), yüzeyinde portakal rengi pigment (lipofuksin) kümelerinin bulunması, lezyonun sınırlarının optik diske 3mm’lik mesafe içinde bulunması durumunda melanomdan şüphelenilmelidir.
Lokalize koroidal hemanjiomlar; pigment epitelinin fibröz metaplazine ve hiperplazine neden olarak melanomla karışabilir. Tümörün komşuluğunda ya da üzerinde retina dekolmanı, sekonder retinoskizis görülebilir. Tanısında floresein angiografi ve USG değerlidir. Koroidal osteoma; tipik olarak genç kadınları etkileyen, nadir görülen, kemikleşmeye neden olur. En sık optik disk yakınlarında ya da arka kutupta yerleşmiş, kavuniçi-sarı renkli çıkıntılı sınırlara sahiptir. Koroidde lokalize kitle görünümünde granulomatöz lezyonlar, amelanotik melanomlar ile karışabilir. İdiopatik olabileceği gibi, sarkoidoz ve tuberkülozda görülebilir. Melanomla karışabilecek diğer bir lezyon olan yırtıklı retina dekolmanı varlığında, lezyonda dalgalanma olması ve bir retinal yırtığın varlığı ayırıcı tanıda yardımcıdır. Değerlendirirken koroid dekolmanı, koroidal neovasküler membranlar, metastatik kanserler, lenfomatöz ve lösemik infiltrasyonun da melanomla ayırıcı tanısı yapılmalıdır.
Hastada tedaviye karar verirken etkili olan faktörler arasında; tümörün boyutu, tümörün lokalizasyonu, intraoküler yayılım varlığı, klinik olarak diğer organlara metastaz varlığı ya da yokluğu, etkilenmiş gözün görme durumu, hastanın yaşı, hastanın genel sağlık durumu, hastanın ve doktorun kişisel tercihleri yeralmaktadır.
Koroidal melanomun tedavisinde çeşitli tedavi seçenekleri vardır. Son yıllara kadar enükleasyon tek tedavi seçeneğiydi. Günümüzde gözün ve mevcut olan görmenin korunması için alternatif tedavi seçenekleri de kullanılmaktadır. Seçilmiş vakalarda plak ya da yüklü partikül radyoterapi veya gamma knife radyocerrahisi tercih edilebilir. Küçük tümörlerde ise lokal tedavi seçenekleri olarak, krioterapi, lazer fotokoagülasyon, transpupiller termoterapi, lokal rezeksiyon ve daha az sıklıkla, fotodinamik tedavi, monoklonal tedavi mevcuttur.
Üveal traktus lenfatik drenajdan yoksun bir vasküler yapıya sahip olduğu için tümör yayılımı başlıca lokal ya da damar yoluyla olur. Eğer preaurikuler, submandibuler veya lenf nodu tutulumu varsa primer tümörün subkonjuktival yayılımı mevcuttur.
Sistemik metastaz genellikle hematojen yolla ve özellikle karaciğere olur. Akciğer, kemik ve subkutanöz nodüller sıklıkla tutulur. Hastaların 2/3’ünde karaciğer fark edilebilir metestaz bölgesidir. Genellikle çok büyük tümörlere sahip yüksek riskli hastalarda metastaz olabileceği düşünelerek sistemik tarama yapılması için onkoloji konsültasyonu istenmelidir. Hastadan karaciğer fonksiyon testleri, abdominal ve pelvik USG, akciğer grafisi gerekirse akciğer CT istenmelidir. Hastanın takip edildiği klinikte PET görüntülemenin bulunması durumunda sistemik tarama için PET görüntüleme tercih edilebilir. Koroid melanom nadiren optik siniri ya da onun meninkslerini tutar. Koroidal melanom metastazları kontralateral koroide nadiren olur. Literatürde bildirilmiş diğer nadir melanom metastaz bölgeleri kalp, pankreas, dalak ve midedir.
III. METASTATİK TÜMÖRLER
Çoğunlukla intraokuler metastatik tümörler koroidde görülürken, diğer dokular iris, silyer cisim, optik sinir ve nadiren retina ve vitreusta da görülebilir. Etkilenen insanların %80’inde sadece bir gözünde tek bir tümör içerirken %20’si multıple ya da bilateral tümörler içerir.
Kadınlarda en sık göze metastaz yapan kanser meme kanseri iken akciğer kanseri de sık görülür. Erkeklerde en sık görülen primer kanser tipi akciğer kanseridir. Gözünde meme karsinom metastazı gelişen hastaların %90’ında oküler tutulum olmadan önce meme karsinom tedavi öyküsü mevcuttur. Akciğerden oküler metastaz gelişen hastaların yaklaşık %70’inde pulmoner lezyon hikayesi mevcut değildir. Gastroenterik ve gastroüriner sistemden kaynaklanan metastatik tümörlü hastalarda da oküler tutulum ilk belirti olabilir. Görmede bulanıklık veya görme bozukluğuna neden olur. Retinaya metastazlar oldukça nadir görülür, beyaz, birleşik yapı göstermeyen lezyonlardır.
Metastatik tümörlerin tanısını koymada ve üveal melanomlardan ayırmada yapılan A mod USG son derece önemlidir. A mod USG ile yüksek iç yansıtıcılık görülürken, spontan intralezyonel vaskuler pulsasyonlar görülmez. B mod USG ile koroidal melanomlar akustik boşluk ile karakterize iken metastatik tümörler nisbeten daha akustik parlaklık içerir. CT ve MR görüntüleme, metastatik tümörü gösterebilir ama amelanotik melanomdan ayırt etmek için yeterli bilgi sağlamaz. Floresein angiografi, metastazların primer melanomlardan ayrılmasında genellikle faydalı olmaz. Geniş çaplı olmayan intralezyonel damarlar erken fazda rölatif hipofloresan, geç fazda difüz hiperfloresan olarak görülür. Şüpheli vakalarda sitolojik inceleme için ince iğne aspirasyon biyopsisi yapılabilir.
Prognoz, üveal metastaz tanısını takiben sağkalım süresi, primer kanser tipine bağlı olarak 1-13 ay arasında değişir. Metastatik karsinoid tümör uzun sağkalım süresi ile uyumlu iken, meme karsinomun üveal metastazında sağkalım 9-13 ay arasında değişir. Kısa sağkalım süresi tipik olarak akciğer kanser, genitoüriner ve gastrointestinal sistemden kaynaklanan metastazlarda görülür. Ayrıca prognoz, hayati organlara metastatik tutulum ve yaygınlığına, tümörün RT ya da kemoterapiye cevap verebilirliğine bağlıdır.
Metastatik tümörlü göz için temel tedavi seçeneği, radyoterapi veya kemoterapidir. Kemoterapi, görme fonksiyon bozukluğu olmayan oküler tutulum olan tümörlerde ilk tedavi seçeneğidir. RT genellikle ayaktan tedavi edilen hastalara verilir. Radyoterapi sonrası sıklıkla direkt tümör boyutunda küçülme ile hastanın semptomlarında hızlı bir düzelme görülür. Bazı hastalara RT ve KT birlikte uygulanır. Kombine tedaviyi uygulamada etkili olan faktörler; intraokuler tümör yayılımı ve büyüklüğü, tümörün sayısı, intraokuler doku üzerinde tümör etkileri, etkilenmiş görme düzeyi, diğer gözün görme statüsü, ekstraokuler hastalık yayılımı, hastanın yaşı ve hastanın genel sağlık durumudur. RT ve KT dışında bazı gözlerde lokal tedavilerde uygulanması görmeyi arttırma amaçlı olarak yapılabilir.
- LENFOMATÖZ VE LÖSEMİK İNFİLTRASYON
Sistemik lenfomalı hastalarda sıklıkla neoplastik fundus lezyonları gelişir. Yaygın vitritis ve subretinal boşlukta lenfomatöz hücre akümülasyonu ile sarı beyaz plaklar şeklindedir. Visseral ya da SSS lenfoması olduğu bilinen hastalarda tipik fundus bulguları intraokuler lenfoma tanımlanmasına yardımcı olur. Florosein angiografisinde tipik RPE altı lezyonları içeren kitle gözün erken dönemde hipofloresan, geç fazlarda kademeli olarak kenarlarda artan hiperfloresan görünümü söz konusudur.
Vitreusun hücresel infiltrasyonu, vitreus sıvısının sitolojik incelenmesi ile tanımlanabilir. SubRPE yada koroidal lezyonlu hastalarda lenfoma tanısı, İİAB ile konabilir. Bu hastalarda tanı oldukça zordur. İlk aşamada diğer üveitleri taklit edebilir ve etiolojisi bulunamadığında idiopatik üveit gibi düşünülerek steroid tedavileri başlanabilir. İlk aşamada steroid tedavisine kısmi ve geçici bir yanıt alınması da yanıltıcı olabilir. Özellikle ileri yaşlarda vitritis ve subRPE sarı beyaz infiltratlar görüldüğünde lenfoma akla gelmeli ve sitolojik inceleme için vitreus biopsisi ve SSS lenfoması yönünden taraması yapılmalıdır.
Lösemik oküler tutulum sıklıkla görülür. Lösemik hastaların otopsilerinde gözlerin %80’inde tutulum sözkonusudur. Klinik olarak retina sık olarak tutulurken, histolojik olarak koroid sık etkilenir. Lösemik hücreler sıklıkla üveal traktusu infiltre eder. Klinik olarak farkedilemeyen gözün lösemik infiltrasyonu USG ile tanımlanabilir. İris infiltrasyonunda difüz beyaz kalınlaşmış iris, pupil kenarında küçük nodüller görülebilir. ÖK’da tümör hücrelerinin toplanması ile psödohipopiyon ve açı tutulumu ile sekonder glokom görülebilir.
Subretinal boşluk ve koroidde sarı depozit şeklinde lösemik infiltrasyon, sert eksudalar, cotton-wool spots, psödo-Roth spotlar görülebilir. Tedavide KT ve/ veya RT tercih edilir.
İNTRAOKÜLER TÜMÖRLERDE TEDAVİ SEÇENEKLERİ
İntraoküler tümörlerin tedavisinin primer amacı, hastaların yaşam sürelerini uzatmak, ikinci amacı gözün yerinde kalmasını sağlamak, üçüncü amacı ise vizyonun korunmasıdır.
- GÖZLEM
İris melanomunda şüpheli bir lezyonun gözlem ile takip edilmesinde lezyonun büyüklüğünün biomikroskopik muayene, goniyoskopi ve fotoğraflar eşliğinde dikkatli biçimde belgelenmesini kapsamalıdır. Aşikar bir inaktivite ile geçen birkaç yıl sonrasında büyüme meydana gelebileceği için gözlemin hayat boyu sürmesi gerekir. Hasta başlangıçta 3-6 ayda bir, ardından 6-9 ayda bir sonra yıllık kontrollere çağırılmalıdır.
Küçük koroidal tümörlü (≤3mm kalınlıkta ve ≤10mm çapında) hastalarda küçük lezyonların doğal gidişatını incelemek için yapılan COMS sonucunda: 2 yıllık ve 5 yıllık tahmini tümör büyüme oranı %21 ve %31 bildirilmiştir. Melanoma bağlı 5 yıllık mortalite oranı, küçük koroidal melanomlarda %1 olduğu görülmüştür. Çeşitli çalışmalar, tedavi başlangıcında tümör büyüklüğünün ve tümör büyüme paterninin mortaliteyi etkileyen iki önemli klinik faktör olduğunu göstermiştir.
Küçük koroidal melanom tadavisi tartışmalıdır. Bazı klinisyenler izlenmesi gerektiğini düşünmektedir. Nedeni doğru tanı koymaktaki güçlükten kaynaklanmaktadır. Bazıları da erken müdahale edilmesi gerektiğini savunmaktalar; bunun nedeni de tümör küçükken tedavi edilmesi, düşük mortalite hızı ile ilişkili olduğunu düşünmelerinden kaynaklanmaktadır.
Tanısı kesin olmayan, tümörün büyüdüğü gösterilemeyen hastalarda, ayrıca stabil lezyonu olan asemptomatik hastalarda, kısmen de yaşlı, genel durumu kötü hastalarda veya tek gözlü ve tümör büyümesi olan hastalarda tedavi etmek yerine lezyonun takip edilmesi tercih edilebilir.
- LOKAL TEDAVİLER
1) KRİOTERAPİ
Krioprobları intraokuler tümör lokalizasyonun seviyesinde skleraya yerleştirilir. Isının azalması ile protein denatürasyonu, pH değişilikliği, hücre membran rüptürüne bağlı hücre ölümü görülür. Ayrıca lokal vasküler etkilenme ile kan akımında yavaşlama, endotel hücresinde yıkım ve lokal immün etkiler görülür. Krioterapiyi takiben konjonktiva ve kapak ödemi, tümör çevresinde retinal ödem, tümörün donmasını takiben tümör içinde hemoraji oluşabilir. Uzun dönem komplikasyon olarak retina dekolmanı gelişebilir. Eğer tedavi başarılı olursa tümör küçülecek ve tamamıyla yok olacaktır.
Küçük periferik retinoblastom için primer tedavi ya da eksternal ışın RT sonrası rekürren tümörlerde sekonder tedavi olarak uygulanabilir. Vitreus bazalinde lokalize küçük tümörler, 3-4 disk çapından küçük tümörlerde krioterapi başarısı yüksektir.
2) LAZER FOTOKOAGÜLASYON
Arka kutupta tümörü besleyen damarlara atım yapılır. Tümörün kan desteği bozulduğu için tedaviden sonra 1 yıl içinde tümör küçülmeye başlar. Xenon ark ile, argon lazer ya diod lazer ile tedavi edilir.
Fotokoagülasyon başarısı, küçük tümör (<3 disk çapı), özellikle arka kupta lokalize, düşük tümör kalınlığı (≤3mm) olan tümörlerde yüksektir. Optik disk ya da foveayı içeren tümörlerde kullanılmamalıdır, santral görme kaybı ile sonuçlanabilir. Fotokoagülasyon tedavi komplikasyonu; katarakt, iris yanıkları, vitreus hemorajisi ve traksiyon etkileridir.
3)TRANSPUPİLLER TERMOTERAPİ
780-880nm arasında diod laser kullanarak hücre membran hasarı, protein denatürasyonu, kromozom hasarı ve mitokondri hasarı ile tümör hücre nekrozu sağlanır. 45-65˚C tümör sıcaklığı sağlanır. Bu uygulama sonrası maksimum 6mm’lik derinlikte kan damarları oklüzyonu ile tümör nekrozu histopatolojik olarak TTT’den 24 saat sonra görülür. Klinik olarak TTT’den birkaç gün sonra tümör nekrozu gelişir. Tümörün nekrotik bölümü USG’de artmış yansıma ile uyumludur. 3-4 ay sonra tümör yüksekliğinde azalma görülür ve radyoterapiden daha hızlıdır. Retrobulber anestezi ile gözün immobilizasyonu ve anestezisi sağlanır.
Çoğu merkezde termoterapi, posterior kutupta küçük koroidal tümörlere, optik sinir ya da foveaya yakın büyüyen küçük melanomlarda ya da görme azalmasına neden olan subretinal sıvı varlığında arka kutupta büyüyen küçük tümörlerde kullnılır.
Optik diske yakın büyük melanomlar bu teknik ile tedavi edilmez. Bunlarda geç rekurrens oranı %30’dur. Bazı melanomlarda tümörün intraskleral yayılımından kaynaklanan lokalize ekstraokuler rekurrenslerde bu tedavinin etkisiz olduğu bildirilmiştir. Şiddetli ortam opasiteleri, yeterli pupil dilatasyonu olmayan ya da periferde lokalize tümörlerde tercih edilmez.
Plak RT’den daha az koroidal hasara neden olur. Tedavi alanlarında fotoreseptör ve sinir lifi hasarına sekonder derin görme alanı defektlerine neden olur. TTT başarısızlığı, tümörün varlığının devam etmesi ve rekurens görülmesidir. Bazı serilerde 5 yılık izlemde rekurens oranı %22 olduğu bildirilmiştir. Tedavi komplikasyonu olarak retinal arter veya ven dal tıkanıklıkları, retina dekolmanı, vitreoretinal traksiyon, subretinal pigment dağılımı, iris atrofisi, fokal lens opasiteleri ve optik disk atrofisi görülebilir. Yapılan bir çalışmada ise primer TTT ile tedavi edilen hastaların %76’sında retinal komplikasyon, %29’unda lokal tedavi başarısızlığı bildirilmiştir.
TTT’yi takiben koryokapillerin %100’ü oklüze olur. Ama orta ve geniş çaplı koroidal damarlarda oklüzyon %24’dür. I125 brakiterapiyi takiben tüm damarlarda oklüzyon görülür. Bu patent damarların varlığı TTT sonrasında damarlara yakın tümör hücre varlığını açıklar.
Optik diske yakın ya da optik diski kaplayan tümörler, 3’den fazla termoterapi tedavi seansı gerektiren tümörler rekurrens açısından yüksek riskli olarak tanımlanmıştır. Amelanotik melanomlarda ise tümör hücreleri tedaviye dirençlidir ve pigmentli tümörlerin tedavisinden %15 daha fazla güç gerektirir. Bu tümörlerde TTT etkinliğini artırmak için tedaviden 30 dakika önce indosiyanin yeşil boya enjeksiyonu yapılabilir. Boyanma ile tümörde kızılötesi ışığın absorbsiyonu artar.
Plak RT ile kombine olarak uygulanırsa sandwich tedavi olarak adlandırılmaktadır. Brakiterapi ile istenen maksimum etkinlik tümör bazalinde görülürken, TTT’nin maksimum etkinliği tümör apeksinde görülmektedir. Tümör rekurrensini azaltmak, radyoterapinin etkinliğini artırmak ve normal doku zararını minimale indirmek için jukstapapiller koroidal melanomlarda plak RT’e ek olarak uygulanan TTT’nin tümör kontrol oranını arttırdığı bildirilmiştir. TTT ve plak RT ile tedavi edilen 270 hastanın 5 yıllık izleminde tümör rekurensinin %3 olduğu, makulopati %18, papillopati %38, vitreus hemorajisi %18, retina dekolmanı %2, katarakt %6 ve NVG %7 oranında geliştiği, enükleasyon oranı %1 olarak bildirilmiştir.
Retinoblastomda TTT uygulanma endikasyonları henüz belirlenmemiştir. Bugüne kadar geniş serilerde, retinaya sınırlı bazal çapı 3mm’den küçük ve 3mm az yüksekliğe sahip ya da minimal subretinal sıvı içeren retinoblastomlarda tercih edildiği görülmüştür. Büyük tümörler ve vitreus seeding bulunan tümörlerde tercih edilmemektedir. Posterior kutupta lokalize tümörlerde tedavi seçeneği olarak TTT tercih edilebilir.
III. CERRAHİ TEDAVİ
1)LOKAL REZEKSİYON
Progresif büyüme gösteren, açı tutulumu olmadan irisin 1/3’ünden az tutulum olan melanomlarda bir tedavi seçeneği olarak geniş iridektomi uygulanabilir. Açı tutulumu olan ve silyer cismi 1/3’ünden fazla tutan melanomlarda iridosiklektomi tercih edilir. İridektomi sonrası kozmetik defektler ve fotofobi görülebilir. Siklektomi ile oküler hipotoni, lens subluksasyonu ve katarakt görülebilir.
Küçük bazal çaplı ve büyük kalınlıktaki silyer cisim ya da silyokoroidal tümörlerde retina ve vitreus intakt olacak şekilde tümörün transskleroüveal rezeksiyonu tercih edilebilir. Bazal çapı 17 mm’den geniş olan, optik sinir tutulumu olan, silyer cismin 1/3’den daha fazlasını tutan ya da yaygın retinal invazyon olan üveal melanomlarda tümörün lokal rezeksiyonu tercih edilmez. Enükleasyon ve radyoterapiye teorik olarak çeşitli avantajları vardır. Enükleasyondan avantajı, kozmetik olarak normal gözün ve görmenin koruması iken RT’ye üstünlüğü cerrahi başarılı olduysa geç dönem komplikasyonların daha az görülmesidir. Vitreus hemorajisi, RD ve katarakt gibi erken komplikasyonlar daha sık görülür. Enükleasyon ya da RT ile sağkalımlarını karşılaştırmak için yeterli kanıt yoktur. Küçük ve anterior yerleşimli tümörlerde visual sonuçlar daha iyi olmakta ve komplikasyonlar daha az görülmektedir. Ekvator gerisinde bulunan büyük tümörlerin lokal rezeksiyonunda komplikasyonlar daha sık görülmektedir.
Tümörün transretinal lokal rezeksiyonu tartışılmalı bir prosedürdür. Vitrektomiyi takiben tümör ve üzerindeki retina eksize edilir. İnsizyon etrafına endolazer yapılır, ağır silikon verilir. Lokal rekurrensi azaltmak için postoperatif radyoterapi ya da fototerapi uygulanabilir. Bazal çapı 10mm’den küçük, optik diskin 2 ya da 3 saat kadranından az tutulduğu, diğer tedavi formları ile görmenin korunamayacağı tümörlerde tercih edilir. Postoperatif görme keskinliği, kolobomun ekstramakuler olması ya da ciddi komplikasyon olmaması durumunda iyidir. Başlıca görülen komplikasyonlar, rezeksiyon sınırında veya sklerada tümörün lokal rekurensi, retina dekolmanı ve ağır silikon kullanımından kaynaklanan katarakt oluşumudur.
2)ENÜKLEASYON
Üveal melanomlu hastalarda genellikle tercih edilen tedavi yöntemi tümör içeren gözün enükleasyonudur. Tümörden kurtulmak için agresif bir tedavidir. Herhangi bir alternatif tedaviden daha çok kullanılır. Basit ve kullanılabilecek en ucuz tedavidir.
Trabeküler ağ ve irisin yarısından fazlasını tutan, yaygın iris melanomlarında tercih edilebilir. Görmenin geri gelmeyeceği büyük silyer cisim melanomlarında, tedaviye dirençli sekonder glokom ve sınırlı ekstraoküler yayılım varlığında tercih edilebilir.
Tedavi almamış hastalar ile enükleasyon arasında prognozu karşılaştıracak yeterli kanıt yoktur. Bu tümörlerin doğal seyirleri hakkında bilgiler sınırlı olmasına rağmen çoğu klinisyen, tedavi edilmeyen üveal melanomlu hastaların fatal seyredeceğine inanmaktadır. Posterior üveal melanomlu hastaların çoğu enükleasyon ile tedavi edilmesine rağmen, görmenin geri gelmeyeceği biçimde görme kaybına neden olan tümörlerde, ağrılı bir gözde tümör varlığında, neovaskülarizasyon varlığında, tümör volümünün, intraoküler volümün %40’dan fazla olmasında, alternatif tedavi başarısızlığı durumunda tercih edilir.
Lokal rekürrensi azaltmak ve tümöre bağlı mortaliteyi azaltmak için adjuvan preoperatif veya postoperatif RT verilebilir. Büyük tümörlü 1003 hastada yapılan COMS sonucunda cerrahi-radyoterapi kombine tedavi ile enükleasyon arasında sağkalımda önemli bir fark olmadığı görülmektedir.
Bazı araştırmacılar, cerrahi sırasında globun manuplasyonu ile tümör seeding gerçekleşebileceğini düşünerek dokunmamayı tercih etmektedir. Bazıları da tümörün radikal redüksiyonu ile immün kapasitede değişiklik olacağını ve uzak mikrometastazların büyümeye başlayacağını savunmaktadır.
Enükleasyon sırasında tümör hücrelerinin kan yoluyla uzak organlara metastaz olmazsa küratiftir. Eldeki metodlarla mikroskopik metastazı tanımlamak zordur. Tedavi sonrası hastaların yaklaşık yarısı metastastik melanom nedeniyle kaybedilmektedir. Enükleasyondan yaklaşık 4 hafta sonra hasta, protez göz uygulanması için hazır olur.
Retinoblastomda güvenli, etkili ve hızlı tedavi yötemidir ve oldukça yaygındır. Enükleasyon; unilateral ya da bilateral Reese-Ellsworth grup 5 gözler, kör gözde aktif tümör, tümör invasyonundan kaynaklanan ağrılı glokom, diğer tedavi formları başarısız ise aktif tümör mevcut ve takip edilemeyecekse tercih edilir. Uzun optik sinir kesimi patoloji için ideal olandır. Çocuklarda 10mm’den uzun olması istenir. Çıkarımdan sonra ekstraokuler yayılım ve optik sinir tutulumu için glob incelenir. Cerrahi sırasında yerleştirlen konformer 3 hafta sonra çıkartılır. Protez yerleştirilir.
3)EKSENTERASYON
Tanı sırasında yaygın ekstraoküler yayılımı olan hastalara veya enükleasyon sonrasında orbital nüks gösteren vakalarda tercih edilir. Bu radikal cerrahi uygulanan birçok hastanın, sağkalım süresinde diğer konservatif tedavilerle karşılaştırıldığında ilerleme görülmemektedir.
Sınırlı ekstraoküler melanom yayılımı ya da lokalize orbital rekurrens için eksenterasyon önerilmeyebilir. Sınırlı orbital hastalıklı bazı hastalarda enükleasyon veya orbital tümör debulking cerrahisi ile birlikte preoperatif veya postoperatif orbital eksternal ışınlama RT (genellikle 50Gy, yaklaşık 4 hafta) uygulandığında en azından daha efektiftir.
IV.KEMOTERAPİ-KEMOREDÜKSİYON
Retinoblastomda kemoterapi endikasyonu tam olarak belirlenmemiştir. Sıklıkla büyük tümör içeren gözlerde görme potansiyeli olan hastalarda, tümörü küçültmek ve sonrasında fotokoagülasyon, krioterapi, termoterapi ya da plak RT gibi lokal tedavilere olanak sağlamak için kullanılır. İlerlemiş bilateral hastalıklı 1 yaşından küçük hastalarda tercih edilir.
Retinoblastom kemoredüksiyonunda vinkristine, karboplatine ve bir epipodofilotoksin (etoposid ya da teniposid) kullanılır. Bazen çoklu ilaç direncini önlemek için p-glicoprotein inhibitörü olan siklosporin eklenir. Çocuklar 3 haftada 4-8 siklus intravenöz kemoterapi verilir. Çalışmalar göstermiştirki sadece kemoterapi uygulanması tümör boyutunda küçülmeye neden olurken retinoblastomda kür sağlamaz. Bazı küçük tümörler hariç tüm retinoblastomlarda kemoterapiye cevabı pekiştirmek için eksternal ışın ve enükleasyon hariç fokal tedaviler uygulanır. En kötü prognoz R-E grup5a-5b’de görülürken iyi uzun dönem kontroller küçük ve orta çaplı tümörlerde görülür. Tedavi komplikasyonu olarak sekonder non-okuler kanser gelişebilir. Topoizomeraz II inhibitörü olan Epipodofilotoksinler (etoposid-teniposid) kullanımı tedaviden ilk 2 yıl içinde sekonder lösemi gelişimini indükler. Yüksek kümülatif doz ve yoğun tedavi programı artmış risk ile uyumludur.
- RADYOTERAPİ
1) PLAK RT (BRAKİTERAPİ)
İlk olarak 1930’larda Moore tarafından radon kullanımı ile başlamış olmasına rağmen, günümüzde plak RT için ABD, Kanada, İngiltere’de en sık kullanılan izotop İodin 125 iken Almanya’da ruthenium 106’dır. Kullanılan diğer izotoplar Rh106, Rn202, PI103, Co60, Au198’dir. İodin125 doku penetrasyonu iyi, kaynağı uygun şekilde örten diğer oküler yapılar ve sağlık personeli için en az riske sahip sık kullanılan izotoptur.
Brakiterapi için tümörün sınırı metilen mavisi ile belirlenir. Aynı alan ayrıca diatermi ile işaretlenir. Transparan Perspex maket aplikatörü geçici olarak tümör üzerine yerleştirilir. Kılavuz sütürler skleraya konur. Maket aplikatör aynı büyüklükte bir radyoaktif plakla yerdeğiştirilir. Plak tümörün regresyonunu, tümörde yeterli radyasyon dozunu (genellikle tümör apeksinde 80-100gy) sağlayana kadar yerinde kalır ve sonrasında çıkarılır.
Ortalama tedavi süresi yaklaşık 5-6 gündür. Radyoaktif plak yerleştirilmesi ve çıkartılması lokal anestezi ile yapılır. Hasta plak RT süresince hastanede kalır, plağın çıkartıldığı gün taburcu edilir. Yeni yayınlar optimal minimal dozu 0.7-1Gy/saat episkleral plak kullanımını önermektedir. .
Büyük, yaygın olan ve cerrahi olarak rezeksiyon uygulanmayacak iris melanomlarında tercih edilir. Büyümesi kanıtlanmış ve seçilmiş küçük melanomlar, mevcut görmenin korunma potansiyeli olan çoğunlukla orta çaplı ve bazı geniş çaplı koroidal ya da silyer cisim melanomlarıdır. Lumbroso ve ark. anterior üveal melanomlu olgulara Iodin 125 plak RT uygulayıp ortalama 62 ay takip etmişler. Çalışma sonunda 5 yıllık sağkalım oranı %88.3, 5 yıllık metastaz oranı %4, lokal rekurrens oranı %1.5, ortalama görme keskinliği 20/40 olarak bildirilmiştir. 5 yıllık izlemde görülen oküler komplikasyonlar arasında %50.3 katarakt, %18.3 makulopati, %19.3 intraoküler inflamasyon ve %10.6 glokom ilk sıraları almaktadır. Ayrıca optik nöropati, retina dekolmanı, keratit ve vitreus hemorajisi de bildirilmiştir.
Brakiterapi ile görme sonuçları radyasyon retinopatisi ve papillopati gelişimine bağlı olduğu kadar tümörün büyüklüğüne ve lokalizasyonuna da bağlıdır. Fovea ya da optik diske yakın lokalize ve büyük tümörlerde görme sonuçları kötüdür.
Yapılan bir çalışmada kötü görme keskinliği için risk faktörleri, retinal invazyon, artmış hasta yaşı, I125 izotopu kullanılmış olması, optik diskten 2mm daha yakın olması olarak tanımlanmıştır. 5 yıllık izlemde tedavi komplikasyonu olarak %25 retinopati, %24 makulopati, %22 papillopati, %66 katarakt gelişimi bildirilmişitir. 5 yıllık izlemde hastaların %24’ünde, 10 yıllık izlemde hastaların %34’ünde enükleasyona gerek duyulduğu rapor edilmiştir. 5 yıllık izlemde lokal tümör rekurrensi %9, 10 yıllık izlemde rekurrens %13 olarak bildirilmiştir. Tümör metastazı 5 yılda %30, 10 yılda %55 olarak bildirilmiştir.
Newyork Eye Cancer Center da yapılan bir çalışmada Pallidium103 plak RT veya iodin 125 plak RT ile tedavi edilen hastaların lokal kontrol oranları ve sonuçlar karşılaştırıldığında fark olmadığı rapor edilmiştir.
COMS, I125 plak RT ya da enükleasyon ile tedavi edilen orta çaplı tümörlü hastaların 5 yıllık sağkalımlarını karşılaştırmıştır. I125 plak RT uygulan hastalarda 5 yıllık sağkalım oranının (%82), enükleasyon uygulanan olgulardan farklı olmadığı (%81) bildirilmiştir. Plak RT ile 5 yıl ve daha fazla gözün korunma oranı %85 olduğu rapor edilmiştir. Tedaviden 5 yıl sonra, hastaların %37’sinda görme 20/200’den daha iyi olduğu bildirilmiştir.
Retinoblastomda plak RT’e bağlı görülen yan etkiler, üveal melanomlardan daha az görülmektedir. Melanomlarda uygulanan apikal doz 85Gy iken retinoblastomda 40Gy’dir. Melanomlar genellikle 2.5-10mm yükseklikte iken retinoblastomlar 2-4mm yüksekliktedir.
2)YÜKLÜ PARTİKÜL RT
Oküler tümörlerde radyasyon tedavisi olarak bir alternatif tedavi de proton ya da helyum gibi yüklü partikül radyoterapidir. Eksternal RT’nin amacı tümöre minimal normal doku toksisitesi ile homojen tümörosidal doz sağlamaktır. Bir sklotron ünitesiyle helyum ve protonları göze nakletmek esasına dayanır.
Tümör bazalinin çevresine, episkleral yüzeye tantalum klipsleri fikse edilir. Başın pozisyonu ve dik bakış açısı sağlamak için immobilizasyon gereçleri ile tedavi planlama programı gerekebilir. Floroskopi ile tümörün ve gözün pozisyonu monitörize edilerek tedavi edilir. Tedavi, tantalum klipsleri yerleştirildikten sonra yaklaşık 7-10 gün 5 fraksiyonda aktarılır. Başlangıç dozu yaklaşık 70 cobalt gray eşdeğeridir (CGyE) (63.6 proton Gy x 1.1 rölatif biyolojik etkinlik=70CGyE).
Yüklü partikül tedavinin avantajı ışının çok daha yüksek derecede odaklanması ve nisbeten homojen dozlarda radyasyon aktarılmasıdır. Başlangıçta sahip oldukları enerjiye bağlı olarak belli bir yol aldıktan sonra durmaları ve protonların düz bir çizgide yol almaları nedeniyle tedavi alanı ve parçacıkların dağılma alanı tahmin edilebilir. Hızlandırılmış yüklü partiküller ile minimal dağılım ve radyasyon dozu uygulanması sağlanır.
Radyasyon ışını ayarlanırken, 1mm perumbra etkisi, 0.5mm hasta hareketi, 1mm tümör için hata payı bırakılır. Maksimum radyasyon dozunun %70’i tümöre ulaşımda göz boyunca hareket ederken dağılır. Büyüklükleri veya disk ya da foveaya 4mm’den daha yakın olacak şekilde posterior yerleşimleri sebebiyle brakiterapiye uygun olmayan tümörlerde tercih edilir. Tedavi edilen tümörlerin çoğu tedaviden ilk 6 ay sonra ve genellikle 1-24 ay arasında komplet ya da parsiyel regresyon gösterir.
Retrospektif yapılan bir çalışmada proton radyoterapi ile tedavi edilen 2069 hastanın 5 yıllık sağkalım oranı %79, 10 yıllık sağkalım oranı %64 olarak bildirilmiştir. 5 yılda radyasyon makulopati gelişimi %64, radyasyon papillopati gelişimi %35, NVG %14.6, RI %15.2, ASKK %19 oranında görüldüğü bildirilmiştir. Helyum iyon tedavi sonuçları proton tedavisine benzer bulunmuştur. Helyum iyonları ile tedavi edilen 347 hastada 5 yıllık lokal kontrol oranı %96, 5 yıllık sağkalım oranı %80 olarak bildirilmiştir. Proton tedavisi sonrası lokal rekurrens oranı düşüktür (%2-%5).
Tedavi edilen gözde radyasyon retinopatisi-papillopatisi, katarakt, neovaskuler glokom gibi komplikasyon gelişimi sonucu önemli bir görme kaybı olabilir. Tedavi öncesi görme keskinliği, tümörün optik disk ve fovea ile ilişkisi, tedavi sırasında retina dekolmanının derecesi, tümör kalınlığı, DM gibi sistemik hastalık varlığı vizyonu etkileyen risk faktörleri olarak değerlendirilir.
Gragoudas ve arkadaşları proton radyoterapi ile tedavi edilen foveadan 1 disk çapı içindeki tümörlerin %75’inde ve foveadan 1 disk çapından uzakta tümörlerin %40’ında radyasyon makulopatisi geliştiğini rapor etmişlerdir.
Anterior komplikasyonlar epifora, kirpik kaybı, rubeozis iridis, neovasküler glokom, katarakt gelişimi yüklü partikül tedavisinde daha sık görülür. Radyoterapi komplikasyonu olarak neovasküler glokoma bağlı olarak şiddetli ağrı gelişebilir. Radyoterapi ile tedavi edilen hastaların %5-10’inde lokal intraoküler tümör relapsı görülebilir. Ağrılı görme kaybı ya da lokal tümör relapsı gelişen hastalara enükleasyon önerilir.
Makulada lokalize küçük tümörlü çocuklarda, lokal tedavinin etkisiz olduğu multifokal tümörlerde tedavi seçeneği olarak eksternal ışın radyoterapi uygulanır. İyi bir görme beklentisi olmayan ilerlemiş bilateral retinoblastomlu vakalarda radyasyon bilateral olarak kullanılabilir. Bu vakalarda bir ya da iki gözün enükleasyondan kurtulması istenir. Eksternal ışın radyoterapi, lokal tedaviler başarısız olduğunda kurtarıcı tedavi olarak tercih edilir.
Yapılan retrospektif bir çalışmada Reese-Ellsworth grup 5b retinoblastomlu 284 gözün %60.6’sı enükleasyon ile, %22.2’si eksternal ışın RT ile tedavi edilmiş. Eksternal ışın RT alan gözlerin %49.2’sinde tümör büyümesi görülmezken %41.3’ünde rekurens, %12.7’sinde gözde yeni bir tümör gelişimi görüldüğü rapor edilmiştir. Gözün korunma oranı 1 yılda %81.4 iken 10 yılda %53.4 olduğu bildirilmiştir.
Yaşayan bilateral retinoblastomlu hastalarda sekonder gözdışı kanser insidansı artar. En sık gelişen tümörler; osteosarkomlar (kemik, nazal kavite, nazofarinks), pinealoblastoma, kutanöz melanom, beyin tümörleri, yumuşak doku sarkomları, Hodgkin Hastalığı, akciğer kanseri, meme kanseri de gelişebilir. Tedavi sonrası sekonder kanser gelişiminde ortalama latent dönem yaklaşık 9 yıldır. RT maruz kalmamış Rb gen mutasyonu olan hastalarda 50 yıl içinde sekonder kanser gelişim insidansı %26.5 iken, ERT sonrası ilk 20 yılda %10-20, 50 yılda %58.3’den yüksektir.
3)GAMMA KNİFE RADYOCERRAHİSİ
Gamma knife radyocerrahisi, yerleşimi koordinatlarla kesin olarak belirlenmiş hastalıklı dokunun (tümör, damarsal lezyonlar vb.) gamma ışınları ile yok edilmesini veya büyümesinin durdurulmasını sağlayan tedavi biçimidir. Sadece hastalıklı dokunun ışınlanması, normal dokunun korunması ve milimetrik boyutta anatomik seçicilik sağlaması nedeniyle klasik radyoterapiden çok farklı ve çok daha gelişmiş bir tedavi yöntemidir. Radyoterapiden farklı olarak bir seferde daha yüksek dozda tedaviye imkan tanır.
Küresel yerleşimli 201 adet kaynaktan gelen gamma ışınları bir noktada odaklanarak, biyolojik bir etki yaratır. İlk kez 1950’li yıllarda İsveçli beyin cerrahı Lars Leksell tarafından üretilmiş, daha sonra teknolojideki gelişmelere paralel olarak bugünkü modern halini almıştır. 1998 yılında Amerika Birleşik Devletleri F.D.A (Food and Drug Administration) kurumunun Gamma Knife Radyocerrahisini, nöroşirurjikal tedavi biçimi olarak onaylaması ile tüm dünyada kullanılan bir tedavi biçimi haline gelmiştir. Dünyada 200’den fazla merkezde uygulanan Gamma Knife Radocerrahisi ile bugüne kadar 200.000’den fazla hasta tedavi edilmiştir. Gamma Knife, cerrahinin bir seçenek olmadığı hastalarda girişimsel olmayan bir alternatiftir. Seçilmiş vakalarda, cerrahinin fiziksel travmasını ve ciddi komplikasyonlarını ortadan kaldırmaktadır. Bu etkili tedavi yöntemi ayakta yapılan, genellikle hastanede yatış gerektirmeyen, hastaların belli sürelerle takipte kaldıkları bir süreçtir.
Gamma Knife, hedef etrafındaki normal dokuyu koruyarak, keskin tedaviye olanak vermektedir. Operasyon öncesi çekilen MR, beyin anjiyografisi gibi radyolojik görüntüleme yöntemlerine dayanılarak belirlenmiş hedefe, sıfıra yakın hata payı ile yüksek doz radyasyon vermektedir. Hastaların işlem sonrasında hemen normal hayatlarına dönmelerine olanak vererek uzun sürebilen hastanede kalış sürelerini ve komplikasyonları en aza indirmiştir.
Gamma Knife Radocerrahisinin uygulama alanları:
- Beyin Tümörleri :köşe tümörleri, hipofiz tümörleri ,menengiomlar,
kraniofarengiomlar, kordomalar, diğer tümörlerin beyin metastaları ve birincil
beyin tümörleri
- Beynin damarsal patalojileri (Vasküler malformasyonlar-AVM)
- Fonksiyonel Bozukluklar: Trigeminal nevralji, geçirilemeyen ağrı, Parkinson
Hastalığı ve epilepsiler
- Posterior üveal tümörler
Gamma Knife Radyocerrahi Avantajları
- Tedavi edilen anormal dokular, etrafındaki hayati yapılara zarar verilmeden yüksek doz radyasyon alırlar.
- Hastalar tedavi sırasında belirgin acı ve rahatsızlık hissetmezler.
- Cerrahi yara açılmaması sayesinde kanama ve enfeksiyon riski yoktur.
- Tedavi özel durumlar dışında hastanede kalmayı gerektirmez. Hastalar ertesi gün normal yaşamlarına dönebilirler.
Gamma Knife Radyocerrahi Prosedürü
Bir gamma knife tedavi prosedürü 4 temel basamaktan oluşur.
1) Çerçeve Takılması (Frame)
Doktora tümörün veya anormal yapının yerinin yüksek kesinlikte gösterilmesini sağlar. Kullanılan alet, stereotaktik kafa çerçevesidir. Başa 4 küçük vida ile sabitlenen bu çerçeveye takılan ek aparatlarla hastalıklı dokunun yerinin MRI veya CT’de kesin koordinatlarla gösterilmesini sağlar. Ayrıca tedavi süresince başın hareket etmesini engeleyerek normal yapıların ışın almasını engeller. Tedavi sırasında gözün immobilizasyonu için %0.75 marcaine ve %2 lidocaine ile retrobulber enjeksiyon yapılır. Tedavi uzun sürecek ise rektuslara transkonjuktival sütür geçilir ve frame bağlanır.
2) Görüntüleme
Çerçeve takıldıktan sonra MRI veya CT’de görüntüler alınır. Görüntüler tümörün, lezyonun ya da anormal dokunun yerinin, şeklinin ve boyutlarının belirlenmesinde kullanılır. Eğer gamma knife radyocerrahisi bir damarsal problem için yapılacaksa problemin yerini belirlemek için angiografi yapılır. Bu görüntüler tedavi planlanmasının yapıldığı bilgisayara aktarılır.
3) Tedavi Planlama
Görüntüler alındıktan sonra doktor tedavi planlaması yapmaya başlar. Bu sırada hasta dinlenebilir, uyuyabilir ve yemek yiyebilir. Ardından Gamma Knife Tedavi Planlama Yazılımı (Gamma Plan) ile doktor tedaviyi şekillendirir. Amaç normal dokuya zarar vermeden, yüksek doz radyasyonu hastalıklı dokunun tamamına vermektir.
4) Tedavi
Tedavi planlanması tamamlandığında hasta tedavi masasına yatırılır. Başı, çerçevenin yardımıyla 201 adet ışını hedefe yönlendirecek olan özel bir başlığa sabitlenir. Tedavi boyunca uyanık kalır ve hasta mikrofon sistemi sayesinde konuşabilir. Tedavi başladığında MRI veya CT’deki çekim masalarına benzeyen tedavi masası Gamma Knife’ın içine ilerler ve tedavi başlar. İşlem boyunca doktor kamera sistemi sayesinde hastayı gözler. Hasta işlem sırasında hareket edebilir, konuşabilir. Tedavi ağrısızdır.
5) Normal Hayata Dönüş
Tedavi tamamlanır tamamlanmaz çerçeve hastanın başından çıkarılır. Eğer angiografi yapılmışsa birkaç saat gözlem altında kalması gerekebilir. Bazı hastalarda hafif başağrısı ve çerçevenin takıldığı yerlerde kızarıklık ve ağrı oluşabilir. Doktorun kararı doğrultusunda hasta ya birkaç saat içinde evine gider ya da bir süre gözlem altında tutulur. Her iki durumda da hasta ertesi gün hayatına kaldığı yerden devam edebilir, işine gidebilir. Tedavi lezyonun özelliğine göre 1-3 saat arasında sürer.
Brakiterapiye cevapsız büyük üveal melanomlar proton ya da helyum ışın RT ile tedavi edilir. Ama bu tedavi pahalıdır ve nadir merkezlerde bulunur. Bazı hastaların gözlerini ve mevcut olan görmelerini korumak için büyük ya da unstabil lokalize üveal melanomlarda gamma knife radyocerrahisi tercih edilir. Gamma knife kullanımının diğer teleterapilere üstünlüğü minimal invazif olmasıdır. Stereotaktik frame başa lokal anestezi altında yerleştirilir. Cerrahi ile yerleştirilen radyoopak klipsler gibi lokalize aletlere gerek yoktur. Çünkü radyasyon dozu tek bir fraksiyonda verilir. Gözün optik fiksasyonu için alet yada malzemeye gerek yoktur. Tedavi beklenenden uzun sürecek ise rektuslara dizgin sütür geçilmesi gibi ek fiksasyon metodları gerekebilir. Tedavi sonrası hasta ilk olarak 2. hafta görülmeli sonra ilk 6 ay ayda bir, sonrasında 6 ayda bir kontrole çağırılmalıdır. Hasta kontrole geldiğinde tam bir oftalmolojik ve sistemik muayenesi yapılmalı, fundus fotografisi alınmalı, Scan A ve B USG yapılmalıdır. Tümörün tedaviye cevabını değerlendirmek için6, 12, 18, 24 aylarda CT ya da MRI , PET-CT istenmelidir.
Yapılan bir çalışmada tümör çevresinde koryoatrofik skar gelişimi tümör regresyonu olarak değerlendirilmektedir. Tümör regresyonu gamma knife radyocerrahisi ile ortalama 4-6 ay sonra görülürken, Ru106 brakiterapi ile daha geç görülmektedir.Tümör apeksinde punktat hemorajilerin görülmesi gamma knife radyocerrahisine erken reaksiyon olarak tanımlanmaktadır. Tümör çevresinde koryoatrofik skar ile tümör boyutunda küçülmenin görülmesi tümör dekstrüksiyonu olarak tanımlanmıştır.
Yapılan bir çalışmada tümör regresyonu ile uygulanan marjinal doz arasında anlamlı bir korrelasyon olmadığı bildirilmiştir. Tümörde küçülme oranının tedavi öncesi tümör yüksekliğine bağlı olduğu belirtilmektedir. Tümör büyüklüğünde azalma ile kombine USG’de artmış yansıma tedavi etkinliğini değerlendirmek için iyi bir kriter olabileceği bildirilmiştir. USG bulgusu olarak düşük yansıma gösteren tümörlü 5 hastada uzun sürede metastaz görülmediği, tümör regresyonu göstermeyen 2 hastada enükleasyon yapıldığı bildirilmiştir.
Langmann ve ark. tarafından ortalama 52.1Gy yüksek doz ile tedavi edilen 31 kişilik grup ile ortalama 41.5Gy düşük doz ile tedavi edilen 33 kişilik grup tümör regresyonları açısından karşılaştırılmıştır. Komplet tümör regresyonu (skar formasyonu) düşük doz grubunda %12, yüksek doz grubunda %26 olduğu rapor edilmiştir. Parsiyel tümör regresyonun (%50-%80 küçülme) düşük doz grubunda %81, yüksek doz grubunda %58 olduğu bildirilmiştir.
Cohen ve arkadaşları tarafından 1990-2000 yılları arasında, üveal melanomlu 196 gözden 118 göze enükleasyon, 78 göze ise gamma knife ile tedavi uygulanmıştır. 5 yıllık kümülatif metastazsız sağkalım oranın enükleasyon ile tedavi edilen grupta %51, stereotaktik radyocerrahi ile tedavi edilen grupta %74 olduğu bildirilmiştir. Multivariate analizi ile iki tedavi grubu arasında sağkalım oranları arasında istatiksel fark görülmediği rapor edilmiştir. Sağkalımda tümör lokalizasyonu (silyer cisim tümörleri kötü prognozlu) ve tümör hacmi en etkili olduğu bildirilmiştir.
Gamma knife radyocerrahisi ile tedavi edilen büyük koroidal melanomlu 100 hastada görme keskinliği tümör lokalizasyonu ile ilişkili bildirilmiştir. Tümörlerin %61’i posterior kutup, %21’i midperiferik ve %18’i silyer cisimde yerleştiği tanımlanmıştır. Midperiferik yerleşimli tümörlerin %71’inde görme keskinliği stabil iken posterior kutupta olan tümörlerin %19’unda ve silyer cisim yerleşimli tümörlerin %0’ında görme keskinliği stabil kaldığı bildirlmiştir (Ortalama radyasyon dozu 50Gy). Lokal kontrol oranı %98, total enükleasyon oranı yılda %6.3 olarak rapor edilmiştir..
Retrospektif olarak yapılan bir çalışmada ortalama 31.4Gy radyasyon dozunda gamma knife radyocerrahisi uygulanan 81 hastada lokal tümör kontrolü %84, progresyonu %16 olduğu bildirilmiştir. Hastaların %25’inde sekonder glokom geliştiği, toksik optik nöropatinin 9Gy’den yüksek, korneal toksisitenin 15Gy’den yüksek, lens toksitesinin 10Gy’den yüksek dozlarda görüldüğü rapor edilmiştir.
Zhetmeyer ve ark. gamma knife radyocerrahisi ile tedavi sonrası radyasyona bağlı yeni asimetrik lens opasiteleri, sekonder glokom (GİB>21mmHg ve/veya antiglokomatöz tedavi gerektiren), üveitis, kirpik kaybı ve eksudatif retina dekolman gelişiminde tümör lokalizasyonun, yüksekliği ve volümün, planlanan tedavi volümün (PTV), total radyasyon dozunun ve hasta yaşının güçlü risk faktörleri olarak belirtmişlerdir. 10Gy/Fraksiyondan fazla yüksek radyasyon dozu, radyasyona bağlı üveitis oluşumunda risk faktorü olarak bildirilmiştir.
Gamma knife ile tedavi edilen orta çaplı koroidal melanomlu 11 hastayı ort. 6 ay takip sırasında hiçbir hastada klinik progresyon görülmediği bildirilmiştir. USG’de artmış internal yansımanın görülmesi RT’ye cevap olarak değerlendirildiği belirtilmiştir. Tümör yüksekliği ort. 4.75mm’den 0.75mm’e azalma olduğu, bazal çapta çok az değişiklik görüldüğü bildirilmiştir. İzlem sırasında 11 hastanın 9’unda görme düzeyi stabil kaldığı, 1 hastada vitreus hemorajisi ve 1 hastada sert eksudaların makulaya yakın olması nedeniyle görme keskinliği azaldığı bildirilmiştir. 1 hastada RD ve 1 hastada kuru göz geliştiği rapor edilmiştir.
40-80Gy arası 50Gy radyasyon dozu ile tedavi edilen koroid melanomlu 22 hastanın ort. 38 aylık izleminde hastaların %84’ünde radyasyon retinopatisi, %70’inde intraretinal hemoraji, %63’ünde maküler ödem ve kapiller nonperfüzyon, %52’inde sert eksudalar daha az sıklıkla mikroanevrizma, neovaskülarizasyon geliştiği açıklanmıştır. İlk ve en sık olarak ort. 8 ay sonra intraretinal hemorajiler görüldüğü bildirilmiştir. 1-22 ay arasında radyasyon ile uyumlu retinal bulguların görüldüğü açıklanmıştır. Çalışmada radyasyon dozu ve klinik bulgular arasında korrelasyon olmadığı bildirilmiştir.
Çinde yapılan bir çalışmada 1996-2004 yılları arasında üveal melanomlu 16 hasta, ortalama 66 ay takip edilmiş. İzlem sırasında 16 hasta yaşadığı ama hastaların hepsinde tümünde tedavi alan gözlerinde körlük geliştiği bildirilmiştir. Lokal kontrol oranı %93.4 olarak ve 5 yıldan fazla takip edilen 13 hastanın 5 yıllık sağkalım oranı %100 olarak bildirilmiştir. 2 hastada korneal ülser, 3 hastada sekonder glokom gelişimi ve 2 hastada kontrol edilmesi şüpheli tümör nedeniyle enükleasyon yapıldığı belirtilmiştir.
RADYASYON RETİNOPATİSİ
Radyasyon retinopatisi, retinal damarları etkileyen yavaş ilerleyen oklüzif mikroanjiopatidir. Damar hasarı, intraretinal hemoraji, mikroanevrizma, cootton-wool spots, vasküler kılıflanma, kapiller nonperfüzyon ve lipid eksudalar görülür. Radyasyon retinopatisinin geç evrelerinde, görmeyi tehdit eden neovasküler glokom, retinal neovaskülarizasyon, vitreus hemorajisi ve traksiyone retina dekolmanı görülür. İskemik optik nöropati, optik sinirde şişme, hemoraji, eksudasyon ve subretainal sıvı ile karekterizedir.
Silyer cisme lokalize geniş tümörlerde 50 Gy ve daha fazla dozda tedavi, neovasküler glokom gelişimine neden olur. Optik nöropati, juktapapiller melanomlarda daha sık gelişir ve 8 Gy’dan daha yüksek dozlarda optik sinir etkilenir.
Radyasyon retinopati, 1500cGy dozunda gözlenir. Radyasyon retinopati eşiği, fraksiyonel plana, radyasyon dağılma sistemi, tedavi edilen tümör büyüklüğüne, DM gibi sistemik risk faktörlerine bağlıdır. I125 plak RT sonrası hastaların %23-43’ünde, proton ışın RT sonrası hastaların %34’ünde radyasyon retinopatisi geliştiği bildirilmiştir. Radyasyona bağlı komplikasyonlar yüklü partikül RT sonrası plak RT’den daha sık görülür.
Radyasyonun kornea üzerindeki etkileri; epitel hasarı, iyileşmede iyi prognoza sahipken, stromal hasar kötü prognoza sahiptir. Çalışmalar 8 günde 72 Gy korneal perforasyona neden olurken aynı sürede 48Gy minimal stromal zedelenme ile reversble epitelyum değişiklikleri görülür.
Radyasyonun lens üzerindeki etkileri; oküler hastalıkların tedavisinde radyasyona bağlı katarakt riski daha fazladır. Tek fraksiyonda 2Gy ya da fraksiyone 8Gy de lenste katarakt gelişim riskini artmaktadır. Doz arttıkça lenste katarakt gelişimi %100 olur. Koruyucular ve ışın kontrol teknikleri ile beklenen radyasyona bağlı katarakt insidansı azalmıştır. Katarakt gelişim potansiyeli klinisyeni, uygun RT seçmekten vazgeçirmez. Cerrahi olarak tedavi edilebilir.
Sklera radiorezistans olduğu için 750Gy ve yüksek dozları tolere edebilir. Radyasyona bağlı lakrimal bez hasarı ile gözyaşı üretimi azalır, irreversble korneal değişiklikler görülebilir.
KAYNAKLAR
1.Deuon H. Char:Diagnosii of Choroidal Melanoma Stephen J. Ryan RETİNA: 647-662
2.Jhonna M. Seddon, Kathleen M. Egan et al: Choroidal Melanoma: Stephen J. Ryan
RETİNA: 663-671
3.Jerry A. Shields, Introduction to management of posterior üveal melanoma: Stephen J. Ryan
RETİNA:683-700
4.Evangelos S.Gragoudas et al: Charged particle irradiation of üveal melanoma: Stephen J.
Ryan RETİNA:703-711
5.Wallace Stewart Foulds et al. Surgical resection of koroidal melanoma: Stephen J. Ryan
RETİNA:713-720
6.A.Linn Murphree, Carla Rother: Retinoblastoma: Stephen J. Ryan RETİNA: 517-547
7.James J. Augsburger, Intraocular Neoplasms: Steven M. Podos and Myron Yanoff:
Testbook of Ophthalmology:10.1-13.9
8.TUMORS: Steven M. Podos and Myron Yanoff: Testbook of Ophthalmology: 17.1-17.19
9.Jeanne Quiery, MD, Robert Takamiya MD, et al. :Uveal Melanoma: Liebel Philips Second
Edition Sounders Testbook of Radiation Oncology: 1443-1460
10.David H. Abramson MD, Beryl McCormick MD, et al.: Retinoblastoma: Liebel Philips
Second Edition Sounders Testbook of Radiation Oncology: 1463-1481
11.Jarge E. Freıre, Luther W. Brady et al. Eye and Orbit: Carlos A. Perez, Luther W. Grady
Fourth Editication Lipincott Williams: 876-892
12.Jack J. Kaanski, İntraoküler Tümörler: Klinik Otalmoloji: 321-352
13.National Center Institute Via The Internet Web Site at http:// Cancer.gov
14.Ophthalmic Pathology and Intraocular Tumors: Basıc and Clınıcal Scıence Course:
Amerıcan Academy of Ophthalmology: Section 4 2003-2004
15.Arun D. Singh, MD, FRCS, Ophthalmic Oncology, Ophthalmology Clinics of North
America: 2005;18(1)
16.Darren J. Bell, MD, Matthew W. Et al.: Choroidal Melanoma: Natural history and
management options: Cancer Control September/October 2004: 11; 296-303
17.Carol C, Shields and Jerry A. Shields, Recent developments in the management of choroidal
melanoma: Current Opinion in Ophthalmology 2004:15: 244-251
18.Bertil Damato MD, Clinical ve Experimental Ophthalmology 2004; 32: 639-647
19.Abramson DH, Beaverson KL et al.: Outcome following initial external beam radioterapy in
patients with Reese Ellsworth group 5b Retinoblastoma
20.Arthur J., Mueller MD, et al.:Stereotatic Radiosurgery of large uveal melanomas with the
Gamma Knife :Ophthalmology 2000; 107: 1381-1388
21.S. Logani, T.K. Helenowski et al., Gamma Knife Radiosurgery in the treatment of ocular
melanoma; Stereotac. Funct. Neurosurgery 1993;61(Suppl 1): 38-44
22.Thiel MJ, Mueller AJ et al., Three year results of stereotactic radiosurgery of large
choroidal melanomas with the gamma knife: Spektrum der Augenheilkunde 2003:17:3
23.Simonova G., Novotny J., et al.; Leksell gamma knife treatment of uveal melanoma:
- Neurosurgery 2002:97(Suppl 5): 635-639
24.Martin Zehetmayer, Klaus Kitz et al., Lokal tumor control and mobidity after one to three
fractions of stereotactic external beam irridiation for uveal melanoma: Radiotherapy and
Oncology 2000:55: 135-144
25.Langmann G, Jendl G et al: High-compared with low dose radiosurgery for uveal
melanomas: J. Neurosurg. 2002:97(Suppl 5):640-643
26.K. Mullner, G. Langmann et al: Echographic findings in uveal melanomas treated with the
Leksell gamma knife: Br. J. Ophthalmology 1998:82: 154-158
27.Robert W, MD, Ronald D, MD, et al: Preliminary experience in the treatment of choroidal
melanoma with gamma knife radiosurgery: J. Neurosurgery 2000:93(Suppl 3):177-179
28.Anton H, MD, Oliver P, MD, et al: Incidence of radiation retinopathy after high- dosage
single fraction gamma knife radiosurgery for horoidal melanoma: Ophthalmology
2002:109:909-913
29.Gerald L, MD, Gerhard P, MD, et al: Gamma knife radiosurgery for uveal melanomas; an
8- year experience: J. Neurosurg. 2000:93(Suppl 3):184-188
30.VML. Cohen, MJ. Carter, et al:Metastsis-free survival following treatment for uveal
melanoma with either stereotactic radiosurgery or enucleation: Acta Ophthalmol. Scand.
2003:81:383-388